一项价值26亿美元的巨额交易在医疗圈霸屏了。
8月10日,荣昌生物创造中国单药授权金额记录,宣布与美国生命科学公司Seagen达成一项全球独家许可协议,以开发和商业化其公司的产品“维迪西妥单抗”。
Seagen这家公司花钱买下了荣昌生物自主研发药物在特定区域的开发权和商业权,还是比大价钱,26亿美元(编者注:约合168亿元人民币)。
不止于此,荣昌生物将获得维迪西妥单抗在Seagen区域净销售额从高个位数到百分之十几的梯度销售提成。Seagen获得维迪西妥单抗在荣昌生物区域以外的全球开发和商业化权益,荣昌生物将保留在亚洲区(除日本、新加坡外)进行临床开发和商业化的权利。
Seagen卖药盈利的钱,还要给荣昌生物高比例分成,我们站着把钱挣了。
Seagen这家公司来头不小,截至目前,在全球已经上市的13款ADC药物中,Seagen参与研发的ADC药物就有3款,其中Adcetris终结了难治性霍奇金淋巴瘤领域40多年治疗方案没有改变的历史,同时也成为了霍奇金淋巴瘤一线治疗的新标杆。被这样的公司肯定,荣昌生物的实力不容小觑。
消息一出,荣昌生物制药盘初冲高近五成至145.5港元,成了半年以来港股最高涨幅。这一切因为一款药物,他背后的技术和名称叫做抗体偶联药物(ADC)。
面对ADC,另一个药厂罗氏可能会理解这种惊心动魄。
对于药厂来说,美国食品药品监管局 (FDA)公布新药评审结果的那天是个特殊的日子,它可能关系着公司的命运。因为没人能莫得清FDA的“脾气”,药厂常常在忐忑中等待“最后审判”,另一头,资本市场的分析师们也开始了长篇大论的审批预演。
但2013年2月22日这一天似乎是一个例外。那一天,大药厂罗氏的抗体偶联药物 Kadcyla (ado- trastuzumab emtansine, T-DM1) 获得了美国FDA批准,用于治疗一种特定类型的乳腺癌,和药物上市之前重要被广泛讨论和预测的日常不同,Kadcyla赢的毫无悬念。
(注:针对HER2阳性同时对曲妥珠单抗和紫杉醇有抗药性的晚期或转移性乳腺癌患者)
这意味着抗体偶联药物作为一种新型的抗癌药物,在被FDA冷落20年后终于将刺刀挥向实体肿瘤,也正式进入蓬勃的发展期。
弹指一挥间,8年过去,2021年6月,我国终于有了第一款自主研发生产的国产ADC药物——荣昌生物的维迪西妥单抗,用于单药治疗特定类型的胃癌(HER2过表达局部晚期或转移性胃癌),也在同时探索着针对乳腺癌、尿路上皮癌、非小细胞肺癌和胆管癌的作用效果。
首款的消息总是振奋人心,即便我们比美国的药厂晚了将近十年,我们或许可以开始思考,ADC药物能替代火热的单克隆抗体,成为中国医药下一个黄金十年的名片之一吗?
时间的指针回拨,一百多年前,“魔术子弹”学说被首次提出,科学家们发现,动物体内具有靶向特异性的抗体可以用来治疗疾病,他们就像子弹一样可以精准狙击,免疫疗法从此登上历史舞台。科学家对人体精密运行的免疫系统开始了长达百年的探索之路。
抗体是最重要的主角,它是一种由效应B细胞分泌的免疫球蛋白,协助免疫系统鉴别、中和抗原或其他外来物质,当动物体受抗原刺激后就可以产生抗体,它的作用很简单,那就是保护。
抗体的类型并不是单一的,它的种类和作用受抗原分子上的“决定簇”影响,可以把这个“决定簇”理解成对效应B细胞产生不同刺激的各种物质的集合,一般情况下,抗原分子都有很多个抗原决定簇,因此,免疫动物所产生的抗体实为多种抗体的混合物,生产出得这些混合物,也叫做“多克隆抗体”。
多克隆抗体虽好,但问题也不少。首先,用这种传统方法制备抗体效率低、产量有限,且动物抗体注入人体可产生严重的过敏反应。那么,如果可以把这些混合物抗体进行分离纯化,做成单一抗体的“纯净物”,是否可以更好的治疗疾病,让其中一种抗体的作用发挥到最大并解决产量和过敏的问题?
经过了多年研究后,我们得到了肯定的答案,科学家发明出了单克隆抗体技术(单抗)。
将人体的效应B细胞和小鼠的癌细胞进行杂交融合,生成的融合细胞既具有瘤细胞不断分裂的能力,又具有免疫细胞能产生抗体的能力,同时,融合后的杂交细胞(杂种瘤)可以产生大量相同的抗体,当其应用于医疗中时,高纯度高特异性将会大大减小副作用。
这项“单克隆抗体技术”有多重要?1984 年,技术的发明人获得了诺贝尔生理学或医学奖,更加深远的影响是,生物医学新纪元因它而到来了。
从1980年代末期第一款鼠源单克隆抗体药品上市开始,单克隆抗体经历多次更新迭代,针对不同适应症的药品接连上市。
截至目前,美国FDA用35年的时间批准超100款抗体药物。其中,2006年抗体药物的批准逐步进入常态化,到2015年FDA批准了第50款抗体,距第一款抗体药物已历时29年。但从第50款抗体到第100款抗体的获批,历时仅6年时间。
尤其是最近几年,抗体药物的巨大潜力被挖掘出来,呈现爆发式增长。以PD-1靶点为例,自2014年首款PD-1肿瘤免疫疗法获批至今,很多研究已证明了它们在多种癌症中的治疗潜力。例如默沙东公司(MSD)的PD-1抑制剂帕博利珠单抗,以及百时美施贵宝(BMS)的PD-1抑制剂纳武利尤单抗等已成为全球“明星”药物。
过去几年,越来越多的PD-1/PD-L1抗体管线进入临床开发,中国也是其中重要的参与者之一。
“大爆发“、“里程碑”,这些词汇来自单克隆抗体的黄金时代,因为单克隆抗体的出现,我们有了可以和更多疾病博弈的可能性,尤其是当我们面对癌症、自身免疫疾病和病毒流行病的时候。
数据显示,现在仍有近870款抗体在临床开发中,约36%的管线集中在10个经过验证的靶点,在中国,针对PD-1/PD-L1、HER2、CTLA-4、EGFR和CD20的抗体管线最为丰富,一些较新的靶点包括4-1BB、LAG3和CD47等。
红火背后,也有问题,一句话道出了天机。不少投资人告诉虎嗅,“目前我们或许不需要那么多PD-1单抗,这已经成为一个残酷的事实。”
简单来说靶点的趋同性限制了价值的想象力,根据米内网数据,在2019-2020年,四大国产PD-1在中国重点省市公立医院中虽呈爆发式增长,但是相比从2019年一季度到2020年三季度动辄翻倍的增长,2020年四季度却已开始有增长速度放缓的趋势。“后PD-1的时代真的来了。”
药厂只有两个选择,要么开发未经验证的新靶点单克隆抗体,和意味着大量的投入和背后无法预估的风险。要么在靶点的海洋里和同行竞争,把自己的药物效果做到最好,或者说没有最好,只有更好。两条路都不容易。
螳螂捕蝉,黄雀在后。相比于单克隆抗体,由于自身特性决定,当面对相同的靶点时,ADC的疗效往往更优。这是否意味着ADC可以后路包抄,迎来更大的机会?
当你读完上面的部分,了解什么是单克隆抗体后,有一个小方法可以让你更好的明白什么是抗体偶联药物(ADC)。简单来说,ADC就像单克隆抗体的儿子,继承了它部分消灭疾病的“超能力”——抗体,还进化出了属于自己的武器——药物,它是抗体和药物的集合体。
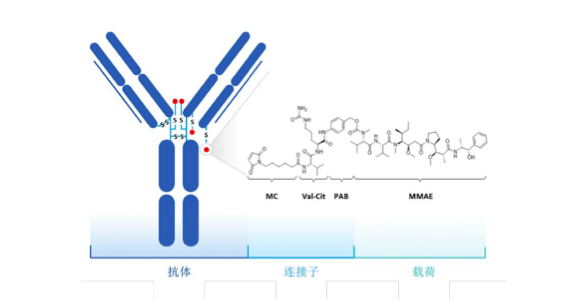
ADC药物是由单克隆抗体与小分子药物(细胞毒素)偶联而成,其结构包括抗体、连接子和细胞毒素三大部分。作用原理是先通过单克隆抗体的靶向作用,特异性地识别肿瘤细胞表面的抗原,然后利用细胞本身具备的内吞作用使化学药物进入肿瘤细胞体内发生药力,从而达到杀死肿瘤细胞的目的。
由于杀伤力强大的小分子药物进入肿瘤细胞体内才开始释放,因而不仅显著提高了药物的安全性,大幅降低了副作用,且极大地增强了有效性,疗效优于靶向同靶标的普通单克隆抗体,成为近年来抗体研究的前沿和发展趋势之一。
ADC近年来十分火热,并进入了获批的密集期,究其根本,是因为它的临床效果表现十分良好。
目前,已经上市的ADC药物的治疗范围包括了血液瘤、乳腺癌、膀胱癌,并且适应症也在尝试拓展到到胃癌等其他实体瘤中,上市药品的指标都展现了令人欣慰的结果。
例如,获批的药品中,Mylotarg树立了白血病的一线疗法,Adcetris则是40年以来FDA批准的第一个难治性霍奇金淋巴瘤的一线用药疗法,Kadcyla作为第一个治疗实体瘤乳腺癌的ADC药物,在早期乳腺癌的辅助治疗中,临床终点头对头数据疗效超过“明星药物”曲妥珠单抗,为HER2阳性乳腺癌提供了更多疗法选择。Enhertu作为乳腺癌三线用药,仍然能够让61%的患者病症缓解,要知道,三线疗法以处于治疗的中后期,这样的数据十分难得。
为何会有这样的效果,我们以荣昌生物的首款获批药物维迪西妥为例,尝试揭开ADC的神秘面纱。
前文我们已经了解,ADC主要分为三部分:单克隆抗体+连结子+药物(细胞毒素)。维迪西妥的抗体部分为靶向HER2(一个靶点)的人源单克隆抗体,连接子部分为 Mc-VC-PAB(一种可被组织蛋白酶剪切的连接子),荷载的细胞毒素为MMAE(一种毒性较强的微管蛋白抑制剂,其半最大抑制浓度(IC50)在亚纳摩尔级别,说明药品效果非常好,很小的用量就能达到不错的效果)。
HER2是一种在多种组织中表达的肿瘤标志物,属于表皮生长因子受体 (EGFR)家族的成员。正常生理状态下,HER2在乳房、胃肠道、肾脏和心脏等多种组织中都存在,主要作用是促进细胞增殖和抑制细胞凋亡。
当HER2基因发生扩增以及HER2基因产物发生过表达(表达太多)时,可能导致细胞不受控制的生长和肿瘤的形成。换而言之,某些肿瘤组织中HER2表达水平将高于正常组织的表达水平,所以,临床上就可以采用靶向HER2的抗癌疗法,针对性地杀灭该类肿瘤细胞,尽可能减少对正常细胞的伤害。
维迪西妥将抗癌剂MMAE选择性地输送至HER2表达的肿瘤细胞,来杀灭肿瘤。这一过程需要“三步走”
第一步,特异性结合肿瘤细胞并促进内吞。维迪西妥的HER2抗体部分以高亲和力结合至肿瘤细胞表面的HER2 胞外结构域,随后维迪西妥单抗分子被细胞内吞并转运至溶酶体。
第二部,酶切并释放毒素。在溶酶体的酸性环境下,活化的溶酶体酶对维迪西妥的连接子进行专一酶切,释放出可以与之共价连接的细胞毒五肽小分子(微管蛋白解聚剂 MMAE)。
第三步,毒素让肿瘤细胞凋亡。在细胞内释放的MMAE结合至微管或微管蛋白,破坏细胞内微管网络,导致有丝分裂细胞周期停止和细胞的凋亡。(整个过程如下图)
除上述途径外,维迪西妥还可通过抑制HER2激活的下游信号通路而干扰肿瘤细胞的转录、生长和增殖,或通过单克隆抗体部分介导的ADCC效应来发挥抗肿瘤作用。
单独拆分ADC各个部分,也会发现不同的巧思和标准。例如,用于杀伤癌细胞的药物部分,可使用的种类很丰富,化疗药物、毒素、放射性核素等对肿瘤细胞具有较大杀伤作用的细胞毒性物质理论上都可以作为抗体药物偶联物的药物部分。
在常规的化疗中,化疗药物原则上在足够高的浓度下都可以杀死癌细胞, 但由于缺乏特异性,在杀伤肿瘤细胞的同时,也易损伤机体正常细胞,导致严重的毒副作用。
ADC通过化学方法把细胞毒素和单克隆抗体偶联,偶联物在理想状况下对正常细胞,尤其在循环系统内不显示活性,只有在肿瘤组织内释放。这样ADC既有特异性识别肿瘤抗原的能力, 也保留了药物杀伤肿瘤细胞的毒性,给药后定向浓聚到肿瘤组织,选择性地杀伤肿瘤细胞。
衔接单抗和药物的偶联接头看似只是辅助,其实十分重要。
简单地说,接头至少要符合两个标准:第一,在体内足够稳定,不会在血液循环中脱落,避免偶练药物脱落产生毒性。第二,在靶点目标的位置,需要有效地释放化学药物。
同时,接头的设计会因ADC的不同而非常复杂,相同的接头在不同的ADC分子中会表现不同性能。除此之外,有些偶联物即使接头不在肿瘤细胞内释放药物也能产生疗效,一部分接头也会因偶联的方式或抗体不同而导致沉淀 (聚合)反应等。因此,选择适当的接头和在适当位点偶联适当个数的药物十分重要。
很多数据显示,临床上成功的ADC具有几乎所有抗体药本身的优点,同时又避免了单克隆抗体的缺陷,尤其重要的是,因为能释放高活性的偶联药物,让ADC疗效明显优于抗体本身。此前,随着Kadcyla和Adcetris的上市,科学家曾评论成ADC尤其在抗肿瘤领域将来有望成为生物抗体药的主流。
经历了烈火烹油、鲜花着锦的黄金十年,单抗市场似乎在等待新的注脚。
国产单抗的起步并不算太晚,我国在1999年批准了国内第一个治疗用单抗产品——注射用抗人T细胞CD3鼠单抗上市,比进口单抗产品在国内上市时间还要早一年,但国内企业并没有抓住单抗发展的最佳时机,到2017年底只有10个批准文号对应的6个品种上市。全球单抗在近10年来迎来了飞速发展,单抗产品已经占据了生物药物的半边天。
我们在拼命追赶的同时,也在等待冲出靶点内卷的困境,它隐藏在药企的年报里。
根据相关创新药企信达生物、君实生物、百济神州、恒瑞医药公布的2020年度业绩数据,4大本土PD-1产品共计吸金近80亿元。即便如此,也无法逃离上文提到的放缓局面。随着医保政策靴子落地,药品谈判不断压缩利润空间,PD-1价格经历几轮下降,PD-1也会告别此前超过90%的高毛利,生物制剂赛道似乎即将进入冷静期。“内忧外患,卷生卷死。”
再加上,国内PD-1扎堆研发推高了市场预期,新华网认为,很多生物仿制药从根本上来说只能比称为“微创新”。据统计,竞争最激烈的肺癌、胃癌、肝癌、食管癌上,每个适应症均有超过10家企业在研。
PD-1药物扎堆也不过是国内药企创新药研发同质化的一个缩影,有限的临床资源一旦被浪费在大量重复的研发项目上,那么真正具有价值的原创药物研发项目进入停滞。
因此,选择自主研发、聚焦新技术的药企往往不明则已一鸣惊人。以荣昌生物为例,招股书中有这样一组数据(下图),2018-2020年这三年经历了连续亏损,但研发投入站营业收入的比例在2020年高达15301.37%,研发投入是盈利金额的153倍。
这一数字或许能给深处迷局的PD-1市场和药企带来关乎未来的部分答案。


 支付宝扫一扫
支付宝扫一扫 微信扫一扫
微信扫一扫









